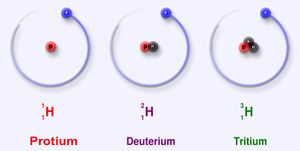
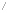중수소
중수소(重水素)는 수소의 동위 원소 중 하나로 일반적인 수소(H)에 중성자가 하나 더 들어가 있는 형태이다. 당연히 질량은 약 2배가 된다. ²H 또는 D(Deuterium)로 표기한다. 삼중수소와 구별하기 위해 이중수소(二重水素)라고 부르기도 한다. 안정하여 붕괴되지 않으며, 지구상의 수소 중 약 1/6400 정도를 차지한다. 화학적 성질은 경수소와 비슷하지만 미묘하게 다르기도 하다.
개요[편집]
중수소는 1931년, 미국의 화학자 헤롤드 유리가 발견했으며, 양성자 한 개와 중성자 한 개로 구성되어 있는 원자핵을 가지고 있는 원자이다.
일반적인 경우, 지구상의 수소 원자와 중수소 원자의 존재비율을 보면, 수소가 99.985%, 중수소가 0.015% 존재한다. 넓은 의미에서는 ²H와 ³H를 중수소라 정의하고 있지만, 존재비가 극히 소량인 방사성 동위 원소인 삼중수소를 뺀 이중수소만 중수소라고 부르는 경우가 대부분이다.
성질과 제법[편집]
중수소 원자 2개가 결합한 분자도 중수소라고 부른다. 상온, 상압에서 무색, 무취의 기체이며, 녹는점은 -254.5°C이고 끓는점은 -249.4°C이다. 이는 수소 분자(H₂)의 성질(녹는점이 -259.2°C, 끓는점이 -259.6°C)과 비교했을 때 높은 수치이다. 이것은 중수소 원자가 수소 원자의 질량에 약 2배이기 때문에, 다른 물리적 성질도 일반적인 수소와 달리, 화학반응에서도 다른 점이 있다. 예를 들면 물을 전기분해하면 ¹H₂가 생성되기 쉽기 때문에 중수가 농축된다. 이 방법으로 중수를 100% 만들 수 있다. 또한 일반적으로 식물은 경수를 흡수하기 쉬운 성질이 있어서, 종류에 따라서는 대략 70%까지 중수를 농축할 수 있다.
중수소 원자 2개가 원자핵 결합반응을 일으켜 삼중수소 혹은 헬륨-3이 생성되면 막대한 에너지가 방출되는데, 항성 초기의 핵융합반응이 이 과정에 해당된다. 핵융합 발전이나 수소폭탄의 관점에서 볼 때는 , 주로 반응 온도 조건이 낮은 중수소와 삼중수소의 핵융합반응이 이용된다. 중수소는 해수에 대량 존재하기 때문에, 핵융합 연료로서 유망한 에너지원으로 평가된다.
용도[편집]
원자로 중수소는 중수를 사용하는 원자로에서 이용된다. 중수를 이용하면 일반적인 수소에서 일어나는 높은 확률의 중성자 흡수없이 중성자의 속도를 줄일 수 있다. 연구용 원자로에서 액체상태의 D2는 중성자를 매우 낮은 에너지와 파장의 상태로 만들어 산란 실험에 적절한 상태로 만들어준다.
NMR 분광기 중수소는 수소핵자기공명 분광기(NMR)에서 흔히 이용된다. 그 방법은 다음과 같다. NMR은 일반적으로 용액에 용해되는 성질의 화합물을 필요로한다. 중수소의 스핀 특성은 생물체의 분자에 존재하고 있는 가벼운 수소와는 다르기 때문에 NMR에서 일반적인 수소의 스펙트럼들은 중수소의 스펙트럼들과 크게 차이가 있다. 그리고 실제로 중수소는 일반적인 수소에 맞춰진 NMR 장치로는 관측되지 않는다. 중수소 용해물( 중수 혹은 CDCl3와 같은 중수소를 포함한 클로로폼)은 따라서 근본적으로 NMR 분광기에서 경수소 화합물들의 스펙트럼들만을 측정하기 위해 사용된다.
약에서도 사용되는데 반응성이 낮아져서 물질대사가 이루어지는 시간이 길어지면, 약효가 높아진다는 사실이 확인됐다.
중수소와 삼중수소의 차이[편집]
수소에는 2가지 동위원소가 있다. 일반 수소의 핵은 양성자 1개 뿐이지만, 중수소는 양성자 1개와 중성자 1개가 들어 있다. 그래서 '중수소'(重水素 deuterium, D, 2H)라는 이름을 갖게 되었다. 그런데 핵에 양성자 1개와 중성자를 2개 가진 '삼중수소'(tritium, T, 3H)가 있다. 그래서 양성자 1개만 가진 일반 수소(1H)는 '프로튬'(protium)이라 부르기도 한다.
중성자 1개를 더 가진 중수소[편집]
중수소는 원래 안정된 동위원소이다. 중수소도 일반 수소처럼 산소와 결합하여 물을 만들기도 한다. 중수소로 만든 물을 '중수'(重水 heavy water)라 부르며, 화학식은 'D2O'로 나타낸다. 이런 중수는 바다나 호수의 물 6,000개 분자 당 1개꼴(0.0156%)로 섞여 있다. 중수소를 따로 분리하려면, 일반 물을 전기분해하여 산소와 수소로 일단 나눈다. 이때 발생한 수소 가스는 일반 수소와 중수소가 섞여 있다. 그러므로 이 두 수소의 원자 무게 차이를 이용하여 분리하면 중수소만 얻을 수 있다.
중수소는 일반 수소와 화학적 성질이 조금 다르다. 예를 들어 중수가 40% 이상인 물(D2O)을 마신다면 인체에 해롭다.
원자폭탄은 우라늄(U-235)의 핵에 중성자를 쏘아 핵분열반응이 한꺼번에 일어나도록 한 것이다. 원자력발전소에서는 원자로 속에서 일어나는 핵분열반응 속도를 조절하여 천천히 핵분열이 일어나도록 한다. 원자로에 중수를 적당량 넣으면 중성자의 속도를 조절할 수 있다. 그래서 중수는 원자로에서 핵분열반응 속도를 줄이는 '감속제'(moderator)로 사용된다.
중성자를 2개 가진 삼중수소[편집]
삼중수소는 중수소보다 중성자를 1개 더 가졌기 때문에, 그 핵은 불안정하여 방사성을 가지며, 그것의 반감기는 12.26년이다. 즉 10그램의 삼중수소가 반감 기간을 지나면, 그 중의 5그램은 가벼운 일반 수소로 변하고 삼중수소는 5그램만 남게 된다. 삼중수소의 반감기가 이렇게 짧은데도 지구에 삼중수소가 적게 나마 남아있는 이유는, 항상 새로 생겨나고 있기 때문이다. 즉 우주선(cosmic ray)이라 부르는 태양 또는 다른 우주에서 오는 강력한 방사선이 지구 대기권 상층의 수소와 충돌하여 삼중수소를 만들고 있는 것이다.
삼중수소는 대기 중의 산소와 반응하면, 방사성을 띤 물(T2O) 분자가 된다. 이 방사성 물은 빗물에 섞여 바다와 호수로 들어오지만, 이들은 양이 적고 방사성이 약하여 생명체에 피해를 주지 않는다.
중수소와 삼중수소는 핵융합반응(nuclear fusion)으로 에너지를 얻으려 할 때 기본 연료가 된다. 핵융합반응이란, 물방울 2개가 만나면 큰 물방울이 되듯이, 2개의 수소 핵이 접근하여 1개의 큰 핵으로 되면 매우 불안정하여 안정해지려 한다. 안정해지기 위해 불필요한 중성자를 내보낼 때 질량이 감소하면서 그와 동시에 막대한 에너지가 나오게 된다. 이러한 핵융합반응은 바로 태양에서 끊임없이 빛과 열(에너지)이 방출되는 이유이다. 수소폭탄은 수소 동위원소의 핵을 융합시켜 한순간에 막대한 에너지를 내도록 만든 가장 강력한 무기이다.
수소폭탄은 핵융합반응 속도를 조절하지 못한다. 그러나 만일 핵융합반응 속도를 조절하면서 에너지를 얻을 수만 있다면, 인류는 에너지 걱정을 영원히 하지 않아도 된다. 즉 전력을 생산하기 위해 화석연료를 더 이상 사용하지 않아도 되고, 이산화탄소 배출과 공해 가스 발생을 염려하지 않아도 된다. 오늘날 우리나라를 비롯한 몇 나라는 핵융합반응 속도를 조절할 수 있는 핵융합원자로의 개발 연구에 큰 힘을 기울이고 있다.
오늘날 핵융합원자로 연구에는 여러 나라의 과학자들이 공동으로 참여하고 있다. 그들에게 가장 어려운 과제 하나는 수소의 핵을 융합시키는데 약 1억도의 고온이 필요한 것이다. 수소의핵은 양성자(+)만 가졌으므로, 그 핵들은 서로 반발하여 자연적으로는 핵융합이 일어날 수 없다. 그러나 1억도 정도로 고온이 되면 그 에너지에 의해 중수소와 삼중수소의 핵은 융합반응을일으킨다.
핵융합반응은 다음 4가지 방향으로 일어날 수 있다.
- 중수소 + 중수소 → 헬륨-3 + 중성자 + 에너지(3.2MeV)
- 중수소 + 중수소 → 삼중수소 + 수소 + 에너지(4.0MeV)
- 중수소 + 삼중수소 → 헬륨-4 + 중성자 + 에너지(17.6MeV)
- 중수소 + 헬륨 → 헬륨-4 + 수소 + 에너지(18.3MeV)
과학자의 계산에 따르면, 지구상의 물에 포함된 중수소를 전부 핵융합로의 연료로 사용한다면, 태평양에 담긴 물 500배에 달하는 양의 석유 에너지와 같을 것이라고 한다.[1]
각주[편집]
- ↑ 전파과학사, 〈중수소와 삼중수소의 차이〉, 《네이버 블로그》, 2014-07-26
참고자료[편집]
- 〈중수소〉, 《위키백과》
- 〈중수소〉, 《나무위키》
- 권혁재 기자, 〈핵융합발전 핵심연료 ‘중수소’ 경제적 분리 시스템 개발〉, 《기계신문》, 2019-12-016
- 배종인 기자, 〈중수소, 반도체용 생산 국내 업체 검토〉, 《e4ds 뉴스》, 2021-08-10
같이 보기[편집]