"산화제"의 두 판 사이의 차이
(새 문서: '''산화제'''(酸化劑, oxidizing agent)는 산화·환원 반응에서 시키고 자신은 환원되는 물질이다. 반대로 상대를 환원시키는 물질은 '''[[환원제]...) |
잔글 |
||
| 26번째 줄: | 26번째 줄: | ||
2F₂ + 2H₂O → O₂ + 4HF : 물이 더 강한 산화제를 만나 환원제가 된다.<ref name="순환학회"></ref> | 2F₂ + 2H₂O → O₂ + 4HF : 물이 더 강한 산화제를 만나 환원제가 된다.<ref name="순환학회"></ref> | ||
| + | {{각주}} | ||
== 참고자료 == | == 참고자료 == | ||
* applepop, 〈[https://blog.naver.com/applepop/222171382140 산화제와 환원제(oxidizing agent and reducing agent)]〉, 《네이버 블로그》, 2020-12-12 | * applepop, 〈[https://blog.naver.com/applepop/222171382140 산화제와 환원제(oxidizing agent and reducing agent)]〉, 《네이버 블로그》, 2020-12-12 | ||
2021년 7월 1일 (목) 11:05 판
산화제(酸化劑, oxidizing agent)는 산화·환원 반응에서 시키고 자신은 환원되는 물질이다. 반대로 상대를 환원시키는 물질은 환원제라고 한다. 산화제는 주로 비금속 원소들이 있는데 대체로 전자친화도가 큰 물질들이 그 예이다. 예를 들어 전자 친화도가 가장 큰 플루오린은 가장 강력한 산화제이다.
상대에게 산소를 주거나, 상대로부터 수소를 빼앗거나, 상대에게서 전자를 빼앗는 힘이 있다. 이런 반응의 결과, 자신의 산화수는 감소한다.
대표적인 산화제는 산소(O), 과산화수소(H₂O₂)나 오존(O3)과 같은 활성산소, 불소나 염소와 같은 할로겐족원소(전자를 받아 음이온이 되기 쉽다), 락스(차아염소산나트륨)의 성분의 염인 ClO⁻등의 염소산염(음이온)입니다.
H⁺ + HOCl + e⁻ → ½Cl₂ + H₂O
6H⁺ + ClO⁻₃ + 5e− → ½ Cl₂ + 3H₂O
산성조건에서 일명 락스인 차아염소산염이나 염소산들의 음이온은 강한 산화제이다. 위의 두 반응에서 염소는 전자를 받아 산화수가 각각 +1과 +5에서 0으로 환원되며 산화제가 되었다.[1]
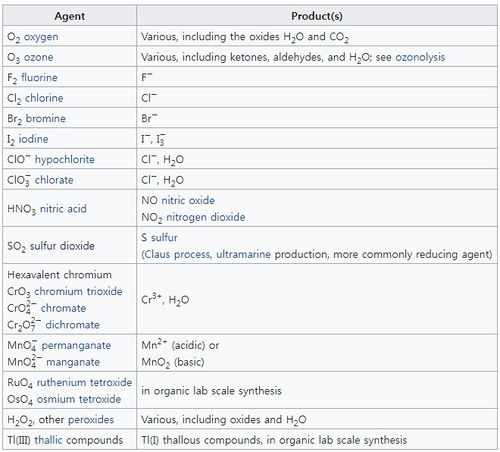
산화제의 종류
산화제의 종류는 아래와 같다.
위의 표에서 O₂, O₃는 H₂O, CO₂가 되면서 수소를 받거나 산소를 주면서 산화수가 0에서 -2로 감소하면서 환원되어 산화제로 사용되었다. F₂, Cl₂ 등의 할로겐족원소들은 F⁻, Cl⁻인 음이온이 되면서 전자를 받으며 환원되어 산화수가 0에서 -1로 감소하였다. ClO⁻, ClO₃⁻는 Cl⁻이 되며 산소를 주면서 Cl의 산화수는 각각 +1과 +5에서 -1로 감소하였다. HNO₃는 NO, NO₂가 되면서 산소를 주면서 결과적으로 N의 산화수가 +5에서 각각 +2, +4로 감소하였다. 이때 산소의 산화수는 -2로 변함이 없다. CrO₃는 Cr³⁺ 가 되며 산소를 주면서 환원되어 Cr의 산화수는 +6에서 +3으로 감소하였다. H₂O₂는 H₂O가 되며 산소를 주면서 O의 산화수가 -1에서 -2로 감소하였다. 만약 H₂O₂가 O₂로 되면 O의 산화수가 -1에서 0으로 증가하며 환원제로 작용한다. 과산화물에서 산소의 산화수는 -2가 아닌 -1이다.
보통 O₂, F₂, Cl₂는 산화제인 반면, 이들의 음이온인 O₂⁻, F⁻, Cl⁻는 환원제이다(단 ClO⁻ 처럼 산소가 붙어있는 음이온은 산화제). 이들의 음이온이 환원제인 이유는 상대에게 산소나 받거나 전자를 주면서 산화수가 증가하기 때문이다. Na, K 는 환원제인 반면, 이들의 양이온인 Na⁺ , K⁺는 산화제이다. 이들의 양이온이 산화제인 이유는 상대에게 전자를 받으면서 산화수가 감소하기 때문이다. 모든 경우에 해당되는 것은 아니나(상대가 더 강한 산화제이냐, 환원제이냐에 따라) 이처럼 일반적인 경우에는 산화수가 큰 원자를 가지면 반응 시 환원되기 쉬워 산화제이고, 산화수가 작은 원자를 가지면 반응 시 산화되기 쉬워 환원제이다.
위의 표에서 CO₂는 산화제의 부산물(생성물)로 나왔다. C의 산화수는 +4이므로 이것은 최대치이다. 따라서 산화수가 작아지면 작아졌지, 더 늘수는 없다. 그래서 산화제이다. 하지만 산소의 산화수는 -2이고 이것은 최대치이므로 산화수가 늘어나면 늘어났지, 더 작아질 수는 없다. 그래서 환원제이다. 즉, CO₂는 상황에 따라 산화제와 환원제 둘 다 작용이 가능하다. 하지만 CO₂는 CO가 되며 상대를 산화시키고 자신은 환원되는 방식의 산화제로써 경향이 더 크다. H₂O는 산화제와 환원제 모두 작용이 가능하다. 위의 표에서는 산화제의 부산물(환원제)로 나왔는데, H₂O가 H₂와 O로 나뉘면 산화제이고, H₂O가 H와 O₂로 나뉘면 환원제이다.
2Li + 2H₂O → H₂ + 2LiOH : 물이 더 강한 환원제를 만나 산화제가 된다.
2F₂ + 2H₂O → O₂ + 4HF : 물이 더 강한 산화제를 만나 환원제가 된다.[1]
각주
- ↑ 1.0 1.1 applepop, 〈산화제와 환원제(oxidizing agent and reducing agent)〉, 《네이버 블로그》, 2020-12-12
참고자료
- applepop, 〈산화제와 환원제(oxidizing agent and reducing agent)〉, 《네이버 블로그》, 2020-12-12
같이 보기